Barriga e lombo do Lírio



Barriga de Lírio
Lombo de Lírio



Tuna Haimation Garum GARUM LUSITANO by CAN THE CAN Garum produzido com atum rabilho do Atlântico, pescado nas águas do Atlântico. Garos de alta qualidade

Sandwiche de pastrami de atum, brioche torrado e salada coleslaw Ingredientes para 2 pessoas: 2 embalagens de pastrami de atum 2 brioches 30 gr de

Pastrami de atum Lombo de atum curado com flor de sal, pimento espelette, pimenta da Jamaica, alho, semente de coentro e funcho desidratado, em ambiente

Muxama de atum Muxama de atum CAN THE CAN, curada com o método tradicional, laranja do Algarve e amêndoas torradas

Bucho de atum Estômago de atum recheado com carne do mesmo, vinho tinto, pimentão fumado, semente de coentro, erva doce, sal e pimenta

“Bucho” de atum fumado Atum, cabeça de cherne, vinho branco, sal, açúcar, paprika, alho, pimenta preta





FICHA TÉCNICA DO PROJECTO
INVESTIGAÇÃO & PROJECTO
CAN THE CAN – Pedro Almeida e Victor Moura Vicente
ARQUEÓLOGIA
ROMAN RUINS OF TROIA – Arqueólogas Inês Vaz Pinto e Patrícia Brum
INVESTIGAÇÃO ALIMENTAR
Centro de Investigação em Agronomia, Alimentos, Ambiente e Paisagem do Instituto Superior de Agronomia: Marisa Santos, Catarina Prista e Anabela Raymundo
ZOOARQUEOLOGIA
Laboratório de Arqueociências da Direcção Geral do Património Cultural – Zooarqueóloga Sónia Gabriel
PALINOTOLOGIA
Laboratório de Arqueociências da Direcção Geral do Património Cultural – palinóloga Patrícia Mendes
FORNECEDORES
Sardines supply Sesibal – Cooperativa de Pescas de Setubal, Sesimbra e Sines, Ricardo Santos
Supply of salt from the Sado Valley – Carlos Bicha & Filhos, Lda, Alcácer do Sal






Recolha primeira amostra para análise


















UNIVERSIDADE DE LISBOA- FACULDADE DE CIÊNCIAS- DEPARTAMENTO DE BIOLOGIA ANIMAL
A ostra-portuguesa, Crassostrea angulata (Lamarck, 1819), tem uma grande importância gastronómica, económica e ecológica a nível mundial. No estuário do Sado foi particularmente relevante na produção aquícola até à década de 1970, quando mortalidades em massa quase levaram à sua extinção no local. Atualmente, tal situação parece ter-se alterado, mas é necessário desenvolver trabalhos científicos que o demonstrem.
O objetivo deste estudo foi atualizar o mapeamento da distribuição da espécie neste sistema salobro e estudar a sua abundância, recrutamento larvar e assentamento.
A distribuição espacial foi analisada no subtidal e no intertidal ao longo da generalidade do estuário. Na zona subtidal foram observadas diversas espécies de bivalves e a comunidade foi significativamente diferente consoante a área do estuário. C. angulata foi mais abundante no Canal de Alcácer, tanto na zona subtidal, como na zona intertidal, e os teores de matéria orgânica e o tamanho médio do grão dos sedimentos foram as variáveis ambientais que melhor explicaram a distribuição de C. angulata na região subtidal. Adicionalmente, os bancos de ostra-portuguesa do Canal de Alcácer, que resistiram ao declínio da espécie no estuário do Sado, são os que se encontram em melhores condições. Foram ainda identificados novos afloramentos mais a montante do que era conhecido.
As maiores abundâncias de larvas de C. angulata estiveram presentes no plâncton na primavera quando a temperatura da água atingiu os 18 – 20 ºC e a produção fitoplanctónica aumentou. O assentamento decorreu após isso, desde finais de maio até finais de outubro. No entanto, não foi regular ao longo do período em estudo, nem uniforme nos locais testados, sendo claramente relevante o sucesso do assentamento em áreas onde não existia substrato natural disponível à fixação.
Os resultados deste estudo indicam que será possível ajudar a recuperação da população de ostra-portuguesa do estuário do Sado aplicando algumas medidas de gestão que facilitem a revitalização dos bancos naturais.
.
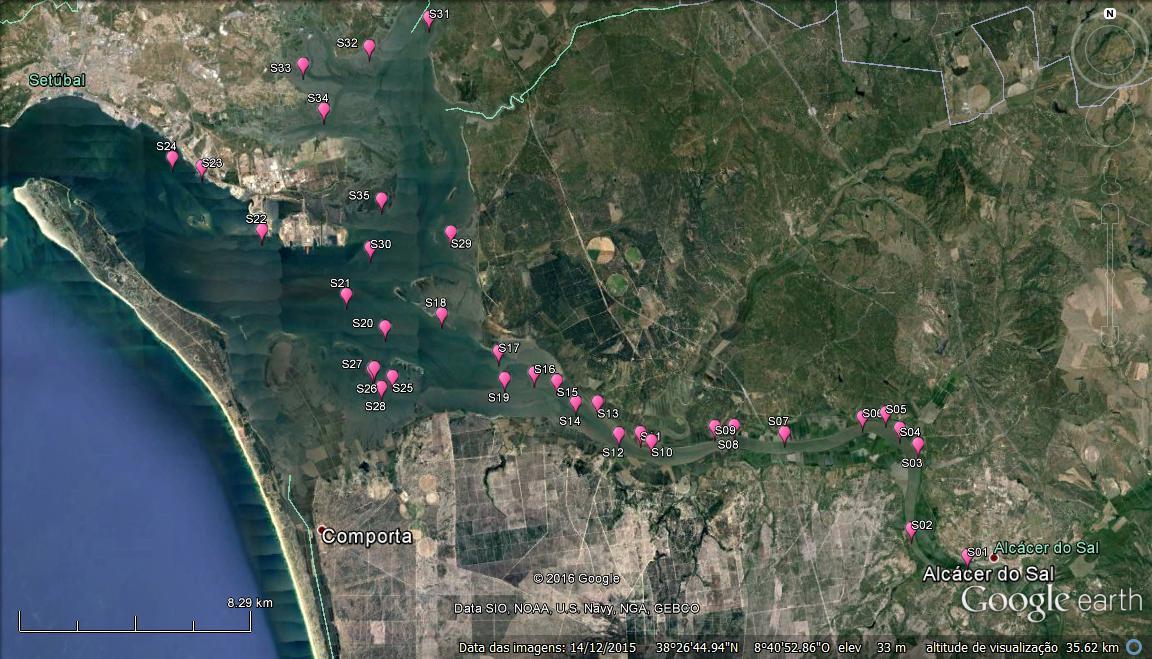
Figura 2.2. Localização das estações de amostragem subtidais estabelecidas para determinação da distribuição de ostra-portuguesa (Crassostrea angulata) e da comunidade de bivalves no estuário do Sado. O conjunto de estações de amostragem (escolhido aleatoriamente) é representativo da área potencial de distribuição de ostra-portuguesa e das diversas zonas do estuário do Sado.
O delineamento experimental permitiu determinar a distribuição de ostra-portuguesa no estuário do Sado e também da restante comunidade de bivalves. Foram contabilizadas 26 espécies de bivalves e um total de 5862 indivíduos deste grupo. As espécies dominantes em termos numéricos foram Ostrea stentina (52 %), Cerastoderma glaucum (13 %), C. angulata (12 %) e Scrobicularia plana (11 %). Situação diferente foi encontrada para os dados da biomassa, que evidenciaram como espécies dominantes C. angulata (70 %) e O. stentina (12 %).
ESPÉCIES MAIS ABUNDANTES:
Crassostrea angulata
Ostrea stentina
Abra alba
Cerastoderma glaucum
Corbicula fluminea
Ensis ensis
Macoma cumana
Mytilus edulis
Ruditapes decussatus
Ruditapes philippinarum
Scrobicularia plana
Solen marginatus
Spisula subtruncata
Venus verrucosa
OUTRAS ESPÉCIES
Abra nitida
Arcopagia crassa
Chamelia gallina
Gari fervensis
Gibbomodiola adriática
Modiolus modiolus
Musculus discors
Parvicardium pinnulatum
Polititapes rhomboides
Ruditapes sp.
Spisula solidaSpisula solida
Venerupis senegalensis
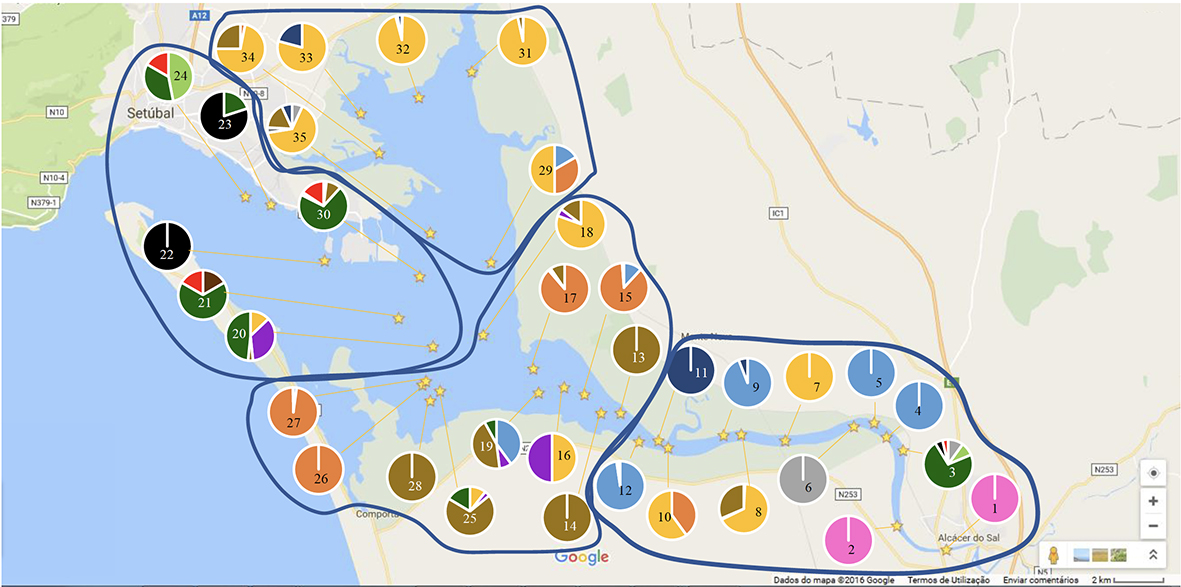
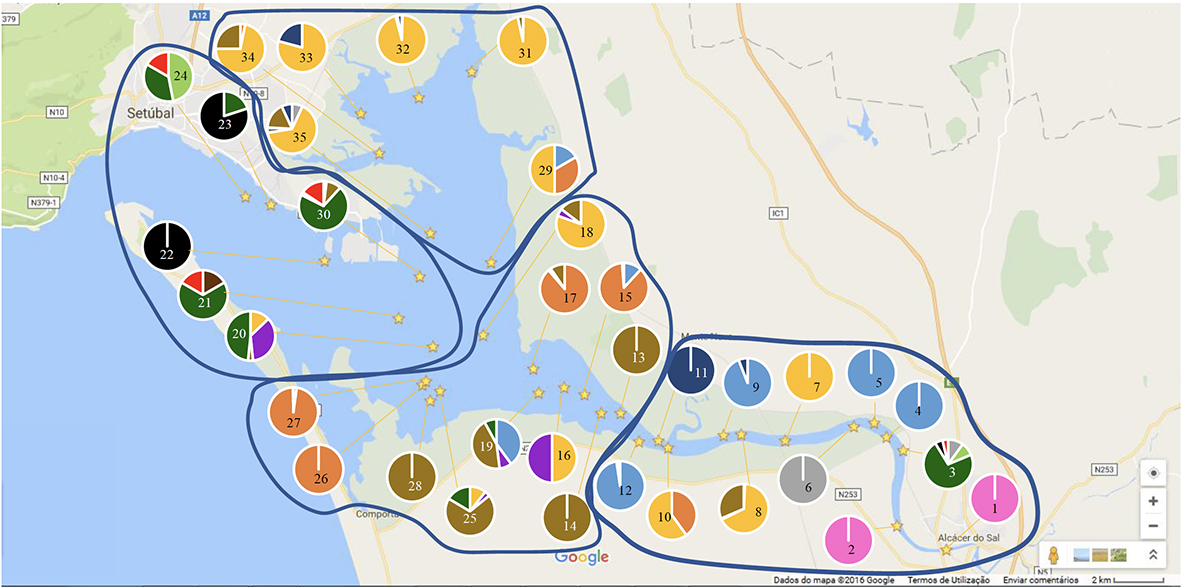
Figura 2.4. Mapa do estuário do Sado com a posição (estrelas) das estações de amostragem estudadas de 2 a 4 de julho de 2015. Cada estação de amostragem tem a si associado um gráfico circular onde se podem observar as espécies mais abundantes. As espécies representadas acima são: Crassostrea angulata (azul claro), Ostrea stentina (laranja), Abra alba (cinzento), Cerastoderma glaucum (amarelo), Corbicula fluminea (rosa), Ensis ensis (verde claro), Macoma cumana (roxo), Mytilus edulis (castanho escuro), Ruditapes decussatus (cinzento escuro), Ruditapes philippinarum (castanho claro), Scrobicularia plana (azul escuro), Solen marginatus (verde esuro), Spisula subtruncata (preto) e Venus verrucosa (vermelho). A zona do Esteiro da Marateca engloba os seguintes pontos de amostragem: 29, 31, 32, 33, 34 e 35. A zona da Baía Central está representada pelos pontos: 20, 21, 22, 23, 24 e 30. A zona do Canal Inferior inclui os seguintes pontos amostrais: 13, 14, 15, 16, 17, 18, 19, 25, 26, 27 e 28. A zona do Canal Superior engloba os seguintes pontos de amostrgem: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 e 12.
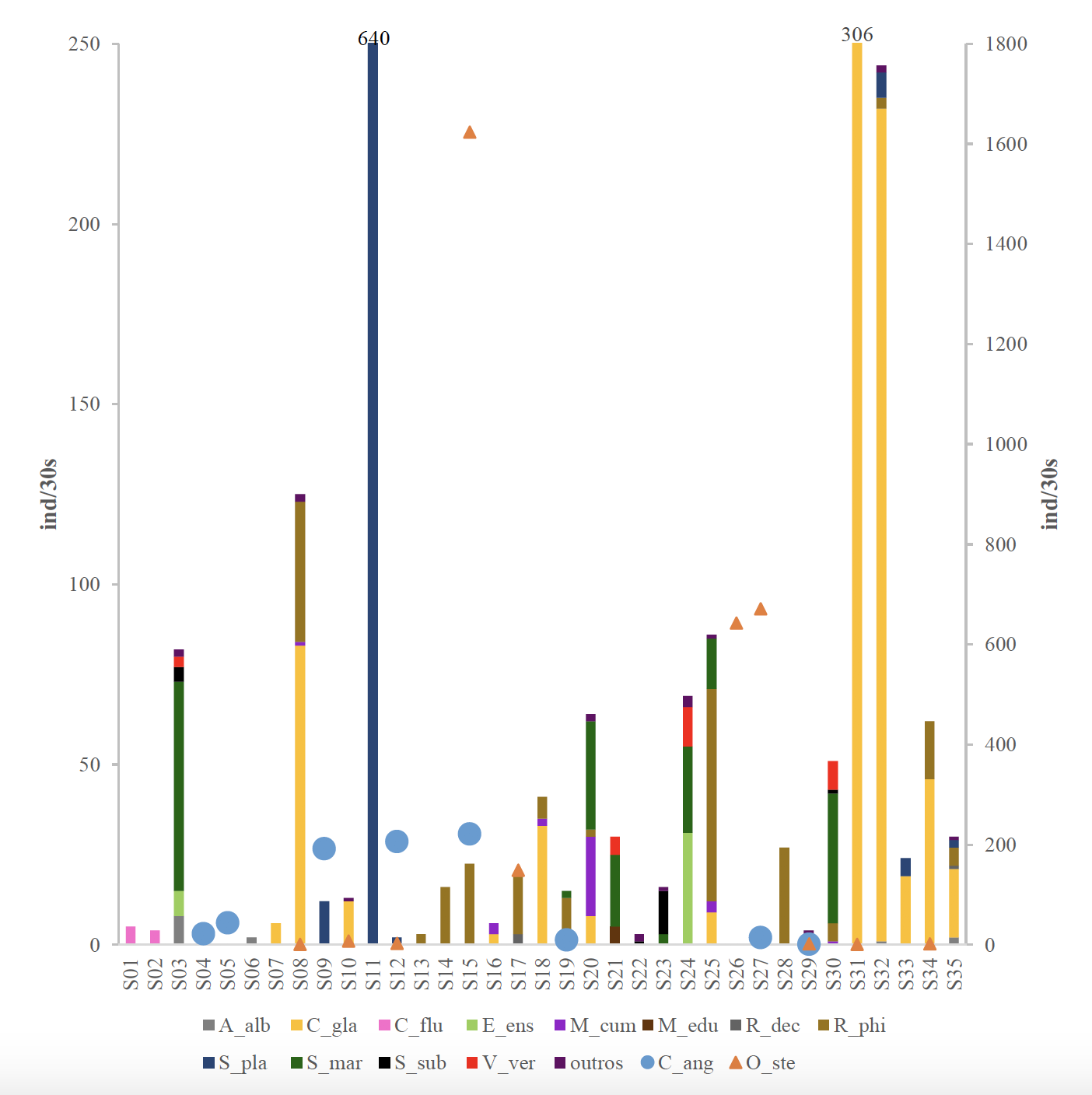
Figura 2.5. Composição específica de bivalves, por estação de amostragem (arrasto), no estuário do Sado. As espécies representadas acima são: Crassostrea angulata (C_ang: circulo azul claro), Ostrea stentina (O_ste: triângulo laranja), Abra alba (A_alb: cinzento), Cerastoderma glaucum (C_gla: amarelo), Corbicula fluminea (C_flu: rosa), Ensis ensis (E_ens: verde claro), Macoma cumana (M_cum: roxo), Mytilus edulis (M_edu: castanho escuro), Ruditapes decussatus (R_dec: cinzento escuro), Ruditapes philippinarum (R_phi: castanho claro), Scrobicularia plana (S_pla: azul escuro), Solen marginatus (S_mar: verde esuro), Spisula subtruncata (S_sub: preto) e Venus verrucosa (V_ver: vermelho). Na categoria «outros» (violeta) estão as espécies de bivalves com menos que 4 individuos. (correspondiam a menos de 0,07 % da amostra total) – as espécies são: Abra nitida (0,034 %), Arcopagia crassa (0,017 %), Chamelia gallina (0,017 %), Gari fervensis (0,017 %), Gibbomodiola adriática (0,068 %), Modiolus modiolus (0,017 %), Musculus discors (0,017 %), Parvicardium pinnulatum (0,034 %), Polititapes rhomboides (0,017 %), Ruditapes sp. (0,017 %), Spisula solida (0,034 %), Venerupis senegalensis (0,051 %). O número de indivíduos das espécies de ostra (Crassostrea angulata, C_ang (círculo azul) e Ostrea stentina, O_ste (triângulo laranja)) referem-se ao eixo do lado direito do gráfico. As barras das estações 11 e 31 foram interrompidas para que fosse possível visualizar as restantes, o valor da contagem da espécie que foi interrompida está na extremidade superior da barra.


Em Portugal, existem quatro espécies de ostra, Crassostrea angulata (ostra-portuguesa), Ostrea edulis (ostra-plana), Ostrea stentina (ostra-anã) e Ostrea cochlear. Contudo, devido às suas características, apenas a Ostrea edulis e a Crassostrea angulata são exploradas comercialmente.
A ostra-portuguesa (Crassostrea angulata) é um molusco bivalve popularmente conhecido como carcanhola, muito semelhante à ostra-do-pacífico.
A distribuição geográfica da ostra-portuguesa está centrada nos estuários e rias desde a zona centro de Portugal continental até à costa de Marrocos, com grande incidência no estuário do Sado.
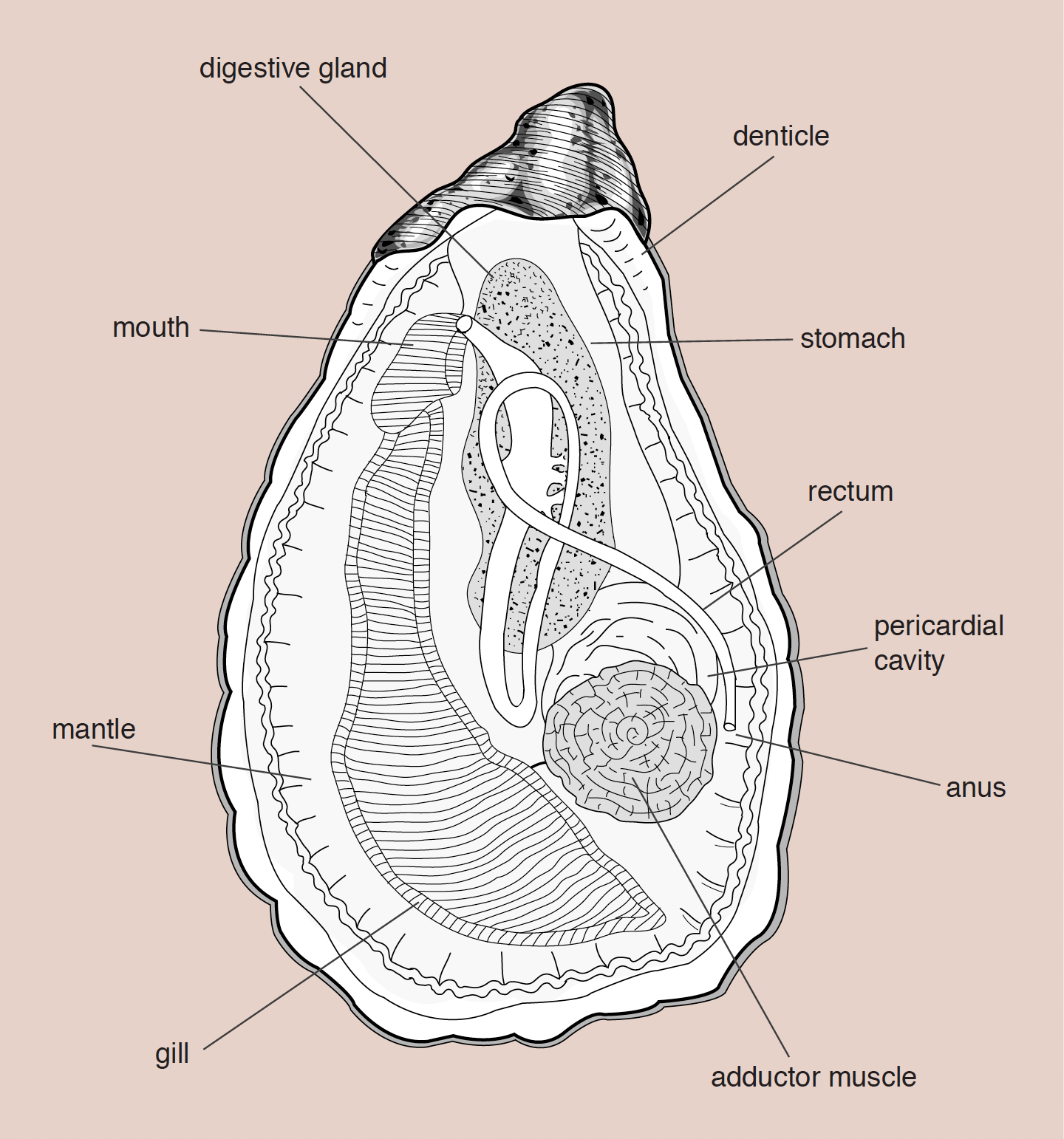
“A concha é constituída principalmente por carbonato de cálcio, que é retirado directamente da água do mar com auxílio de células especializadas localizadas no manto. São animais de corpo mole, lateralmente comprimidos e compostos de duas válvulas articuladas e um potente músculo adutor. A forma e cor da concha da ostra-portuguesa podem ser um pouco variáveis, devido ao tipo de substrato em que está inserida. As ostras que crescem em substratos moles têm geralmente menos lâminas do que as que se desenvolvem em substratos duros. O seu interior é branco, com uma mancha escura perto da ligação do músculo adutor. O corpo é coberto por um tegumento designado “manto”, que está também envolvido no processo de calcificação da concha. Entre os dois lados deste, encontra-se a cavidade palial, um espaço livre dividido pelas brânquias, onde existe a circulação da água através de um processo inalante e exalante (não existe sifão), do qual se obtém o processo de respiração e alimentação.”*
Estudos genéticos mostram que a ostra-portuguesa é originária da Ásia e foi introduzida na Europa através das trocas de mercadoria de navios no século XVI. Diz-se ainda que as ostras agora denominadas por Portuguesas, foram introduzidas na Europa pelas caravelas Portuguesas regressadas do Oriente.
Segundo alguns historiadores, as ostras, conhecidas como «Les Portugaises», são originárias da Índia ou do Japão, tendo viajado para Portugal nas quilhas das naus e como alimento rico em proteínas para as tripulações, nos finais do século XVI. Chegadas aos estuários do Tejo e do Sado, aí se desenvolveram extraordinariamente devido às boas condições naturais daqueles que viriam a ser considerados os maiores bancos naturais de ostras da Europa.
Mas as ostras, eventualmente de outras espécies, já existiam em Portugal, como prova a presença romana no estuário do Sado e Lisboa, que deixou imensos vestígios de consumo de ostras, fazendo prova deste molusco pelo menos desde essa época.
De facto Estrabão refere, no século I a.C., recordando um dos momentos da conquista da Lusitânia por Décimo Júnio Bruto, em finais do século II a.C., quando encontra junto ao estuário do Tagus a antiga povoação de Olisipo, provável entreposto de Fenícios e Gregos:
«Nas margens do rio fortificou Olisipo para ter mais livre o curso da navegação e o transporte dos víveres (…) O rio é muito rico em peixe e abundante de ostras» (Estrabão, Livro 30, I Parte).
Conta-se que em 1886 um navio carregado de ostras de Setúbal com destino a Inglaterra foi obrigado por uma tempestade a procurar refúgio no estuário de Gironda, próximo de Pauillac, na costa oeste francesa. A tempestade pode ter sido longa e o comandante do navio, considerando que as ostras já não estariam em condições, decidiu atirá-las à água. Só que nem todas as ostras estavam mortas e nas águas da Girona ricas em fitoplâncton nasceram colónias espontâneas de ostras que se estenderam à Bretanha.
As ostras do Tejo foram largamente exploradas por comerciantes franceses por volta de 1866, que as levavam para Arcachon.
A ostra-portuguesa foi inicialmente descrita por Lamarck como sendo um endemismo da Península Ibérica. Pensava-se que teria sido introduzida na região francesa de Arcachon em 1867 como uma nova espécie para aquicultura e que, devido ao elevado sucesso, se expandira por toda a França e um pouco por toda a Europa.
Só recentemente é que foram identificadas populações de C. angulata em Taiwan, de onde se pensa que esta será originária. Estudos usando marcadores mitocondriais reportam a presença de populações “puras” desta espécie em Taiwan. Assim é de supor uma origem asiática, que provavelmente é um caso de introdução antropogénica (premeditada ou não) na Europa.
* in Ostras, um fruto de Setúbal. Valorização gastronómica e cultura alimentar do Sado – José Augusto Pinto de Almeida Dissertação



Ostra cozida ao vapor e cortada longitudinalmente

Anatomia básica de uma ostra




A designação Garum é utilizada de forma genérica para definir molhos de peixe obtidos a partir da fermentação em salmoura, onde atuam microrganismos e enzimas presentes no pescado.
Garum é frequentemente imaginado como um molho produzido por meio de putrefação do peixe, e portanto inaceitável para a maioria dos consumidores modernos.
Para compreender a importância e o sucesso das conservas de peixe nas dietas antigas e modernas e para dissipar preconceitos sobre o seu gosto, devemos mencionar os complexos processos bioquímicos e enzimáticos que os produzem.
Segundo Harold McGee, autor americano que escreve sobre a química e a história da ciência alimentar e culinária, quando falamos de Garum podemos classificar o processo como uma “decomposição benigna”.
O que torna o Garum delicioso é precisamente o processo de decomposição química, que desenvolve todo o seu sabor.

As moléculas muito grandes como proteínas, hidratos de carbono, gorduras e óleos, não possuem nenhuma qualidade que possamos registrar com os nossos sentidos químicos.
Através do paladar e olfato apenas conseguimos registrar a presença de pequenas moléculas. São estas pequenas moléculas que podemos “agarrar”, enviando uma mensagem de reconhecimento ao nosso cérebro.
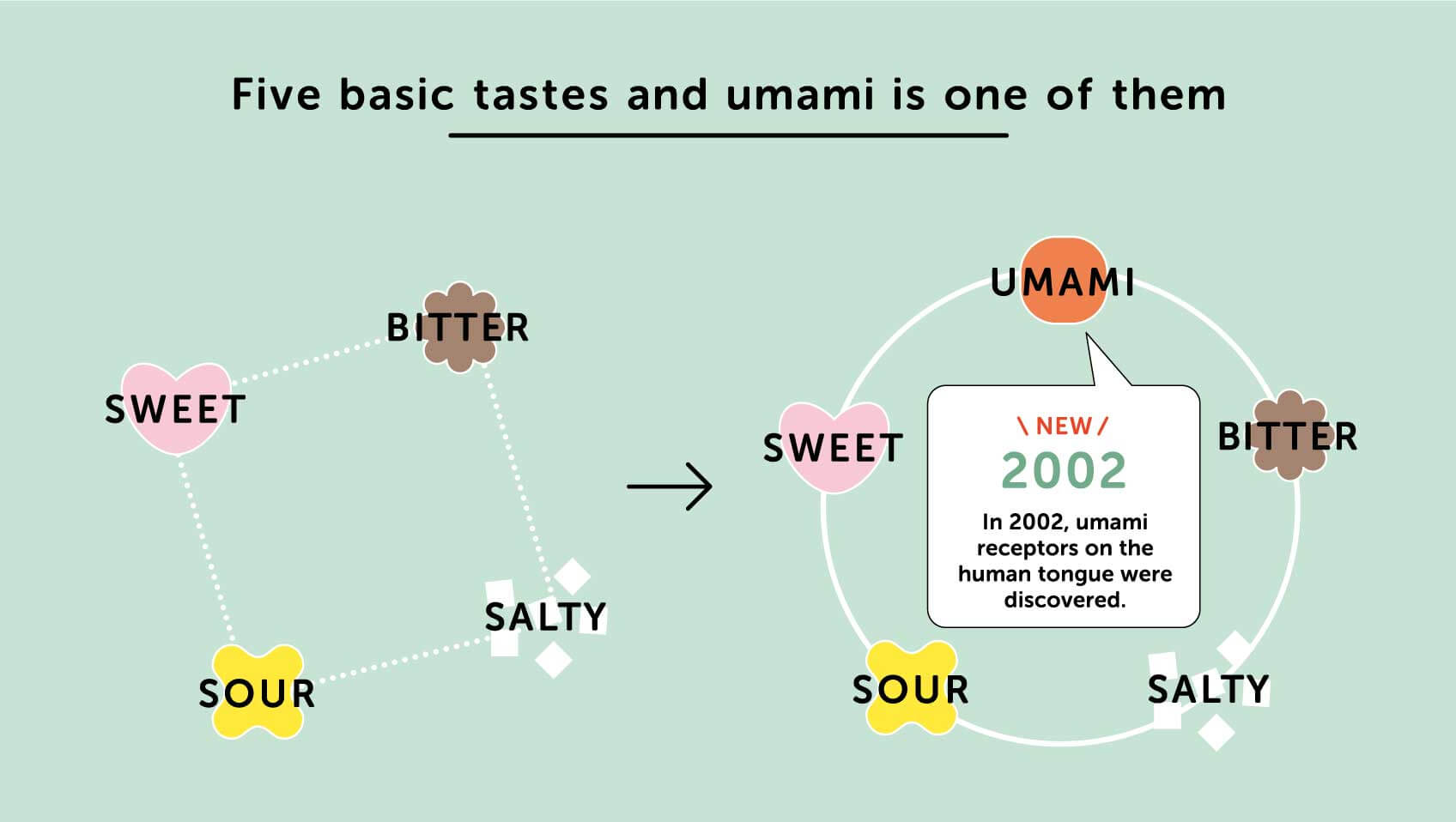
No paladar, temos genericamente cinco sentidos: salgado, azedo, doce, amargo e, recentemente, o umami, que nos dá a sensação de saboroso.
Existem milhares de aromas em nosso mundo natural que podemos captar e identificar, mas essas moléculas precisam ser suficientemente pequenas para que possam voar e alcançar o nosso nariz.
Assim a chave para fazer um Garum é quebrar as grandes moléculas do peixe, principalmente constituído por proteínas e óleo. As proteínas consistem em grandes moléculas construídas por blocos de moléculas mais pequenas que são os aminoácidos. Alguns aminoácidos são suficientemente pequenos para serem detetados pelos sensores na nossa língua. Uns são doces, outros são amargos, salgados ou azedos e alguns dão a sensação de saboroso, ou umami, como é o caso do ácido glutâmico cujos sais são conhecidos como glutamato.
O glutamato é um importante neurotransmissor que funciona como um intensificador de sabor. Pensa-se que o glutamato esteja envolvido nas funções cognitivas no cérebro, como a aprendizagem e a memória.
O que é diferenciador no umami, quando comparado com os restantes sabores, é que enquanto no salgado, azedo, doce e amargo, existem uma grande quantidade de moléculas, no umami existem poucas, mas todas relacionadas ao metabolismo das proteínas, especialmente o glutamato, que são as mais eficazes.
No processo de produção de Garum, as proteínas do peixe são partidas em aminoácidos, principalmente ácido glutâmico e glutamato, que nos dá a sensação de umami, tão rara no resto das nossas captações de sabor.
O facto do garum ter sido tão apreciado nos tempos antigos deveu-se provavelmente à alta concentração de glutamato monossódico, o sal sódico do ácido glutâmico, um dos aminoácidos não essenciais mais abundantes que ocorrem na natureza, que é encontrado naturalmente em alimentos como tomate, cogumelos ou queijo parmesão.
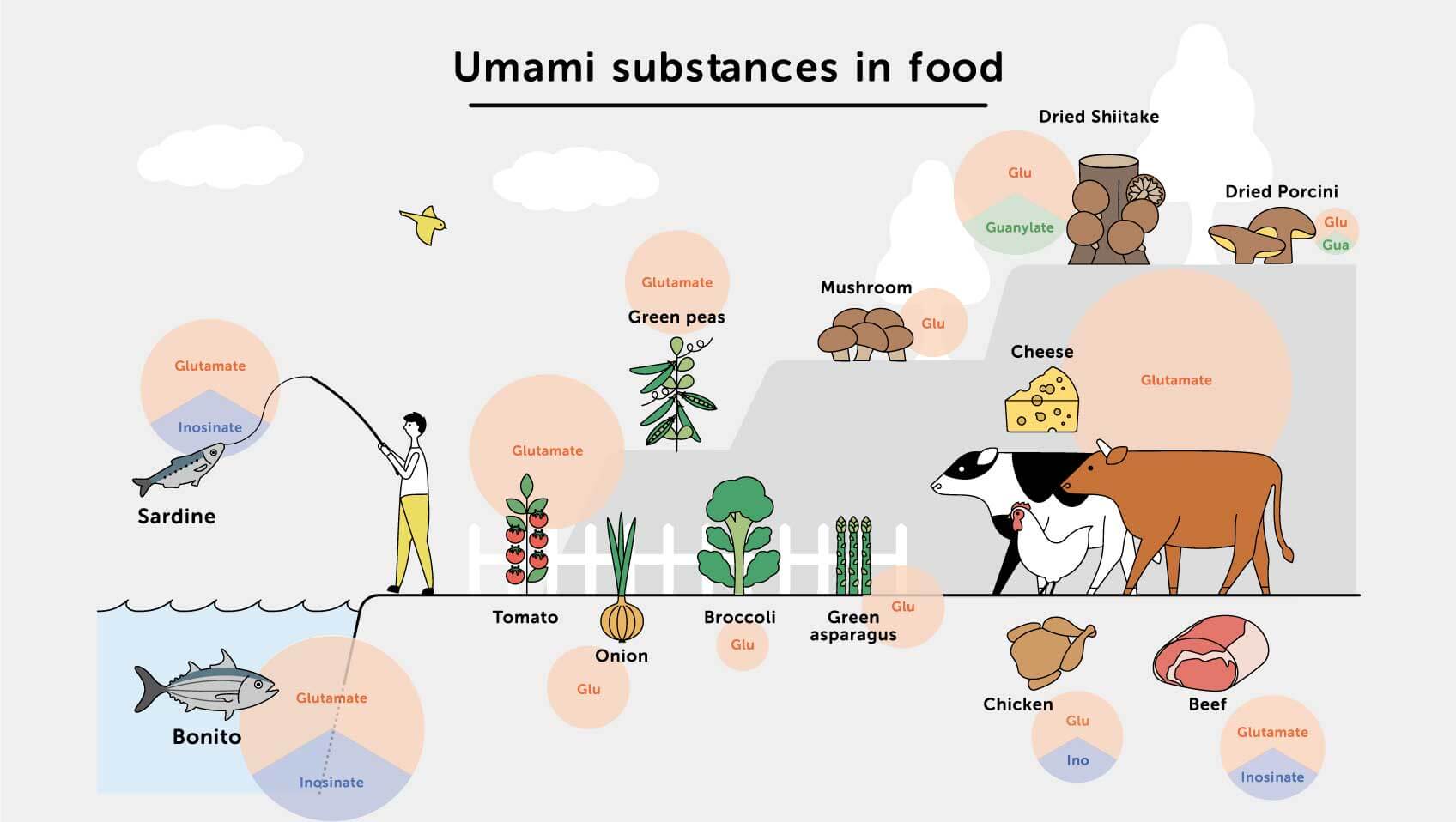
Imagens retiradas de www.ajinomoto.com
O processo de quebra das proteínas ocorre graças à ação de enzimas. As enzimas são também proteínas, mas especializadas no trabalho de quebra de outras moléculas, incluindo as proteínas.
Quando um peixe é capturado e morre, e os seus sistemas param de funcionar adequadamente, a ação das enzimas é revertida gradualmente apenas para a decomposição.
Após a morte, o peixe, como todos os outros animais, passa por uma série processos de decadência cujo primeiro passo é a autólise: a degeneração das células e órgãos através de substâncias químicas, processos desencadeados por enzimas intra-celulares. As enzimas intracelulares, que existem dentro das células que compõem o tecido, quebram lentamente as proteínas do tecido muscular em aminoácidos, incluindo o glutamato, e é dessa forma que o sabor se desenvolve.
A velocidade do processo autolítico aumenta com o aumento da temperatura ambiente, mas podem ser interrompidos se as texturas forem rapidamente congeladas ou desidratadas.
Em consequência da degeneração autolítica dos órgãos do trato gastrointestinal, a flora bacteriana do trato intestinal espalha-se pelo resto do cadáver, iniciando um processo chamado putrefação, a segunda fase da decomposição.
A atividade bacteriana produz inicialmente gases como dióxido de enxofre, dióxido de carbono, amónia, metano etc. e continua com a destruição das proteínas musculares e a produção de aminas tóxicas, como a cadaverina e putrescina.
A verdadeira salga, aquela usada para produzir peixe salgado e carne, produz uma desidratação dos tecidos que bloqueia a autólise, mas precisa de uma grande quantidade de cloreto de sódio (NaCl), processo que podemos comparar à produção de presunto. Neste caso, trata-se de carne da perna de porco, que é salgada para não se estragar, ou seja, não entrar em putrefação, e assim, ao longo dos meses, as enzimas vão decompondo as proteínas dos músculos.
Mesmo em ambientes com menos salinidade como a salmoura, – ainda que com alto teor de sal 10-20% de NaCl – não é impedido o avanço dos processos autolíticos, mas é o suficiente para impedir o início da putrefação parando o desenvolvimento de microrganismos perigosos para a saúde.
Passado algum tempo, o resultado da decomposição em salmoura leva à formação de um líquido perfeitamente comestível, muitas vezes de cor âmbar, salgado e cheio de proteínas, iodo e flúor, histidina e vitaminas A e D (lat. garum, liquamen). Também se obtem uma substância pastosa muito salgada (lat. allec) com excelente valor nutricional.
A outra parte invisível do processo de realização do Garum é a contribuição de micróbios, bactérias em particular. O microbioma humano é a soma de todos os microrganismos que residem nos tecidos e fluidos humanos e em cada local anatómico, a nossa boca, pele, sistema digestivo, possui o seu microbioma específico.
Os peixes têm também milhões de bactérias principalmente nas vísceras, muito mais do que os humanos na pele, porque a sua superfície é húmida. Existem assim milhões de enzimas por grama de peixe, especialmente no sistema digestivo e portanto muitas coisas vivas no tecido dos peixes mortos, enzimas que quebram proteínas e gorduras, para obter energia, alimentarem-se e reproduzirem-se.
No processo desse metabolismo, os micróbios geram os seus próprios conjuntos característicos de moléculas voláteis que são determinantes para o aroma do Garum. As enzimas dos músculos e as enzimas das vísceras – se o sistema digestivo for incluído na preparação do Garum – contribuem muito para a sua qualidade e sabor. São pois os micróbios que geram grande parte do aroma.
Pelo facto de os micróbios estarem envolvidos neste processo, é crucial que na produção sejam seguidos certos cuidados por forma a evitar a presença de micróbios patogênicos e que podem provocar doenças, como o botulismo. O botulismo pode resultar do crescimento de bactérias do género Clostridium, sendo controlado pelo uso do sal, pois estes micróbios não suportam altos níveis de salinidade.
A produção de Garum é um sistema muito complexo, pelo que, diferentes tipos de molhos de peixe, feitos com diferentes processos, diferentes tipos de peixe, diferentes formas de produção, podem resultar em sabores também muito diferentes.
A espécie de peixe utilizada. Nesta produção de Garum em Tróia foi escolhida a utilização de sardinha. Em Tróia foram encontrados principalmente vestígios de sardinha, razão da escolha desta espécie para esta produção, além do simbolismo que a mesma representa para Portugal.
A água de onde provêm os peixes: a água é o lar das bactérias dos peixes. A sardinha utilizada foi pescada pela frota de pesca dos associados da cooperativa de pesca Sesibal, pescadas das águas de Setúbal e Sesimbra.
As partes do peixe que utilizamos: se usarmos as vísceras e o sangue, estamos a usar as enzimas digestivas, que são mais ativas do que as do músculo. Se utilizarmos sangue e fígado, estamos a adicionar muito ferro. O ferro é um catalisador para reações químicas que desenvolve sabores mais rapidamente e mais intensos.
O sal também influencia o Garum: no mediterrâneo é usado menos sal do que nos molhos de peixe da ásia. Utilizámos sal do último produtor activo do Vale do Sado, Carlos Bicha Lda, de Alcácer do Sal.
A temperatura de fermentação determinará que micróbios são capazes de sobreviver nestes altos níveis de sal e com que rapidez eles são capazes de trabalhar. Ao colocarmos o preparado de Garum dentro de uma cetária, irá fazer com este receba os calor das pardes de pedra, que aquecem durante o dia e emanam calor à noite.
A forma como se processa a fermentação, se parada ou agitada, se hermética, exposta ao ar, exposta ou não à luz solar, se é retificada a água ou se são adicionados ingredientes como grãos torrados, vinho, koji, um mundo de muitas possibilidades diferentes. A nossa fermentação é mexida semanalmente e não foram adicionados quaisquer ingredientes.
O período de fermentação. No caso presente calculamos que a fermentação até à conclusão do Garum não será inferior a três ou quatro meses, podendo demorar mais tempo.
O tempo de envelhecimento, que pode ser de vários meses, irá dar a essas pequenas moléculas desenvolvidas durante a fermentação, a chance de reagir entre si e gerar todo o tipo de coisas novas.
Supervisão técnica do texto: investigadoras na área alimentar Marisa Santos, Catarina Prista e Anabela Raymundo do Centro de Investigação em Agronomia, Alimentos, Ambiente e Paisagem do Instituto Superior de Agronomia

Na Lusitânia, há evidência sólida de produção de Garum e salsamenta desde o segundo quartel do século I CE nos estuários do Tejo e do Sado.
O sítio arqueológico de Tróia, situado entre o estuário do rio Sado e o oceano Atlântico, produziu garum em larga escala, tendo em conta os seus numerosos tanques de salga de peixe, que frequentemente revelam uma camada de restos de peixe no fundo, demonstrando a importância da sardinha.
A Tróia romana seria a ilha de Ácala referida pelo escritor romano Rufus Festus Avienus, que viveu no século IV, no seu livro Ora Maritima, atribuição largamente aceite pelos investigadores, embora seja difícil provar que a península de Troia foi originalmente uma ilha ou cordão de ilhas.
Imagem da Biblioteca Nacional de Portugal
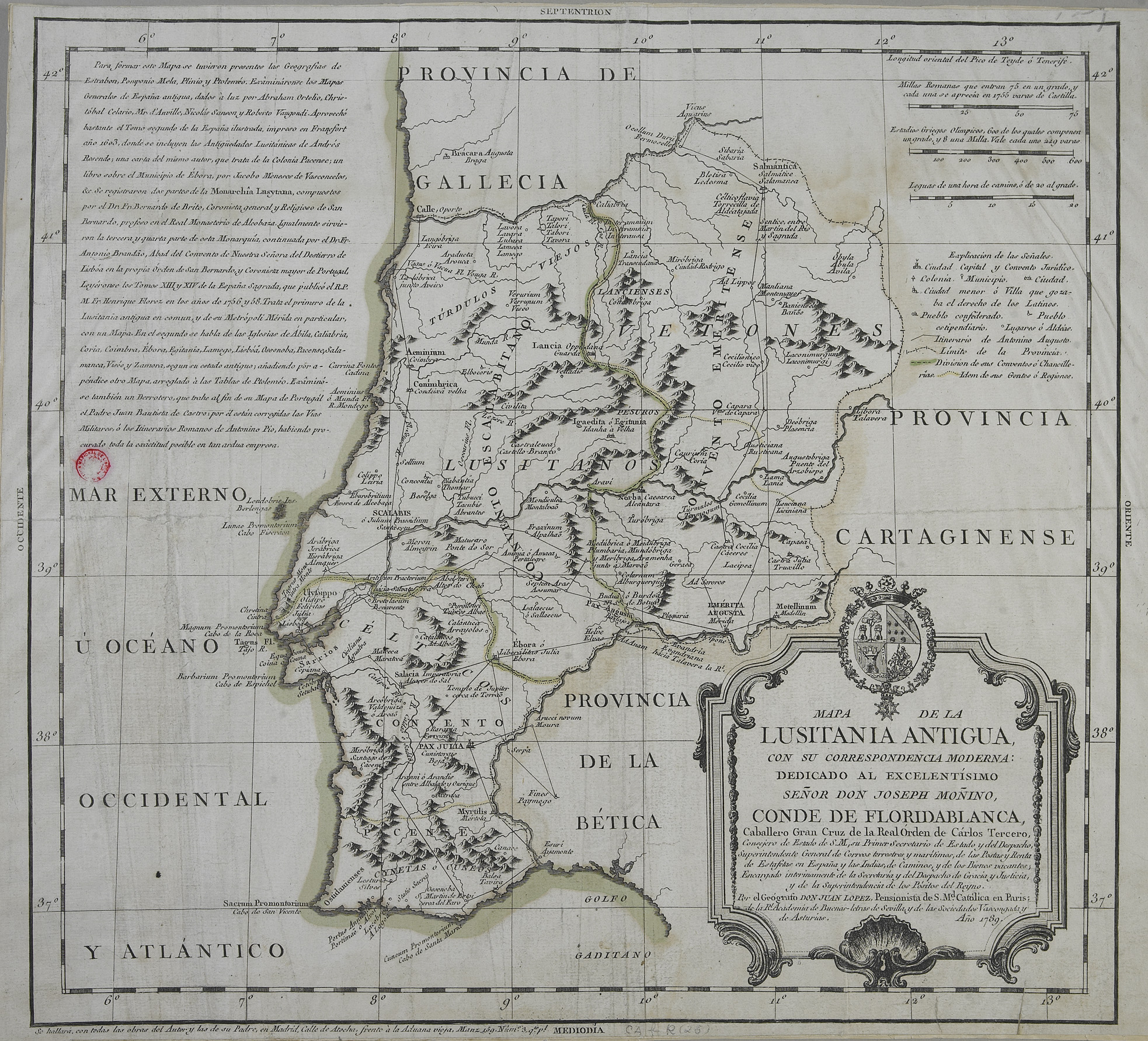
Os testemunhos arqueológicos demonstram que foi um importante aglomerado urbano-industrial que produziu molho de peixe e peixe salgado desde o segundo quartel do século I d.C. até ao segundo quartel do século V, com uma interrupção apenas no final do século II – início do III, com causas ainda desconhecidas.
A sua capacidade de produção, que resulta das suas 29 oficinas de salga identificadas com quase 200 tanques, muitos deles de grandes dimensões, podendo conter 30 000 ou 35 000 litros, faz de Troia o maior centro de produção de salgas de peixe do Império Romano conhecido actualmente.
Nos séculos I e II, teria uma capacidade de produção mínima de 1.429m3, e uma capacidade estimada não inferior a 3.200m3, tendo em conta as oficinas com apenas uma pequena parte a descoberto e outras que já perderam parte dos seus tanques devido à erosão marinha.
Beneficiou fortemente da abundância de peixe e sal que o estuário do rio Sado e o mar circundante ofereciam, mas também do dinamismo económico do Império Romano, sobretudo depois da paz conquistada por Augusto. Tornou-se certamente um importante motor económico da região, exigindo toneladas de peixe e de sal para encher os seus tanques e milhares de ânforas para os produtos acabados e exportá-los.
Uma segunda fase ocorreu entre os séculos III e IV EC, e são visíveis alguns sinais das alterações socio económicas que se verificaram no século III. As grandes oficinas de peixe salgado foram divididas em produções menores, tendo existido uma notória alteração na produção de ânforas, com o aparecimento de novos modelos.
O terceiro período situa-se entre o IV e V século CE, e existem vestígios de ocupação continuada até os séculos VI ou VII. No entanto as chamadas “invasões bárbaras” do século V CE, a interrupção das rotas comerciais e o consequente declínio do comércio estabelecem o colapso da produção lusitana.
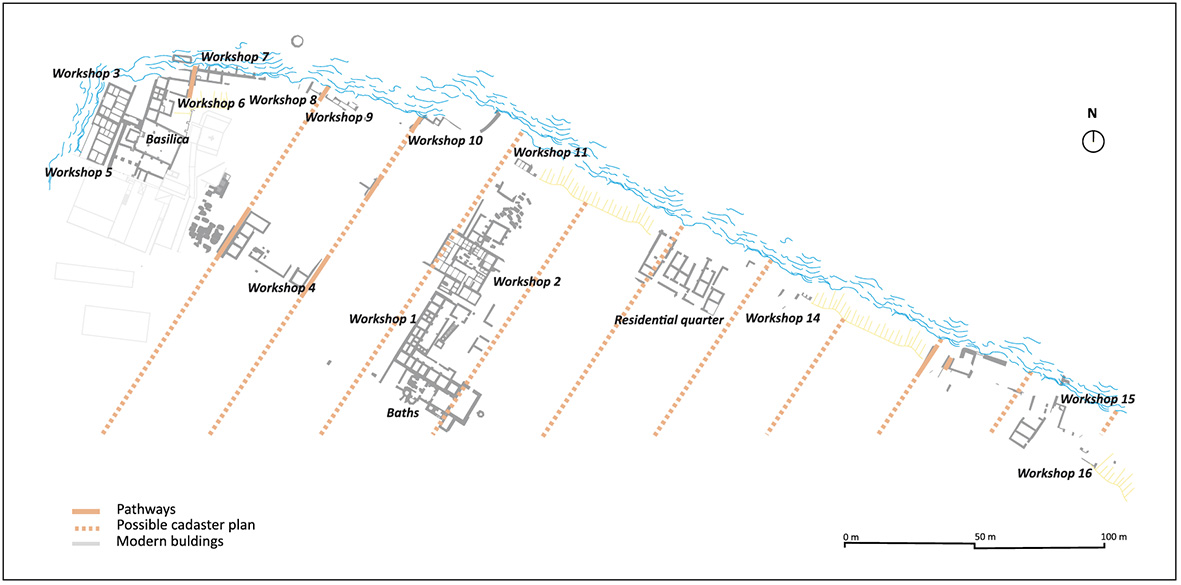
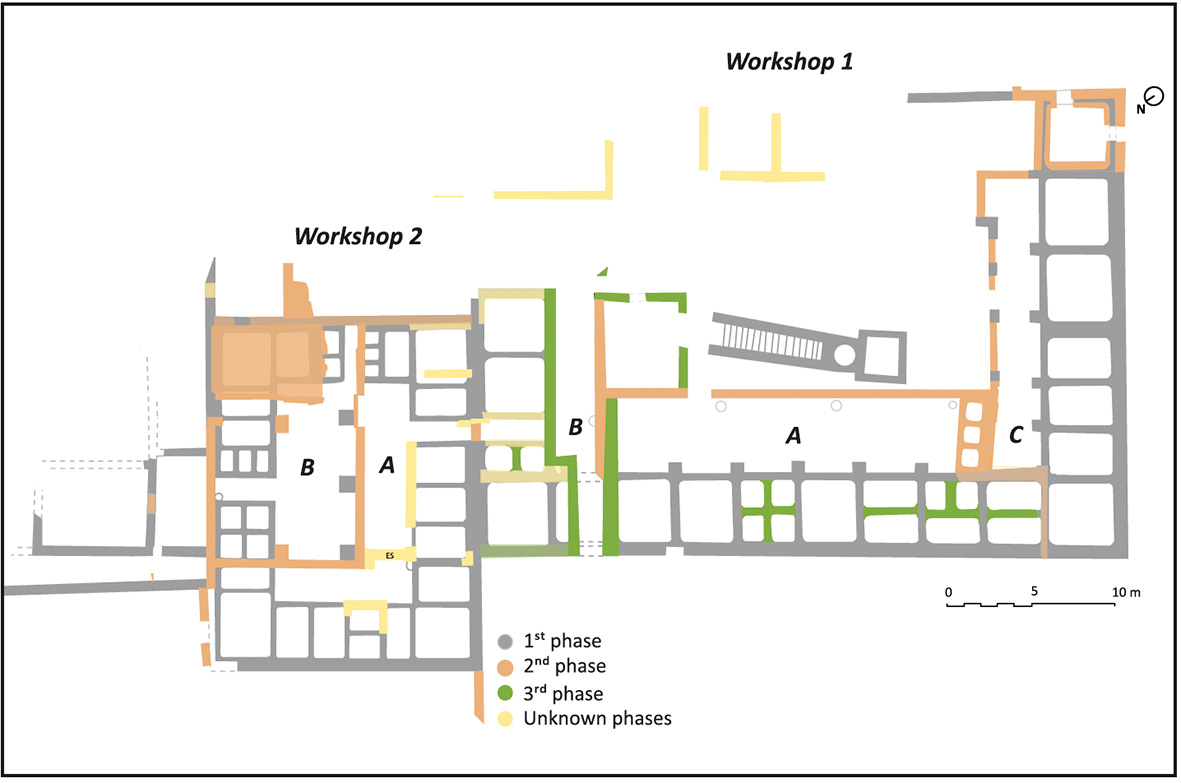
Imagens em: An overview of the fish-salting production centre at Tróia (Portugal) Inês Vaz Pinto, Ana Patrícia Magalhães, Patrícia Brum
O garum produzido em Tróia era realizado principalmente com sardinha, em tanques abertos, com exposição ao ar, embora protegidos do sol direto por telheiros.
Os autores antigos diferenciavam os molhos salgados de peixe (líquidos) do peixe salgado, com diversas preparações (tarichos em grego e salsamenta em latim) à base de peixe.
Em geral, os romanos colocavam o peixe em tanques, especialmente biqueirão, sardinhas e cavalas, adicionado sal em proporções prescritas e, às vezes, várias ervas aromáticas, especiarias ou vinho. Utilizavam pesos para pressionar a mistura, cobriam-na e permitiam que permanecesse ao sol por vários meses. No final desse tempo, retiravam o Garum líquido usando uma cesta, procedendo à filtragem e realizando o transporte em ânforas.
São muitos dos problemas que enfrentamos para compreender a forma como eram feitos estes molhos na antiguidade devido à enorme falta de consenso sobre a forma como eram produzidos e sobretudo porque foram realizados ao longo de vários séculos, o que pressupõe muitas alterações.
É possível utilizar a arqueologia experimental, analisar a natureza dos resíduos de molho de peixe e observar sua formação tentando reproduzir as mesmas condições e receitas utilizadas na antiguidade. A arqueologia experimental supostamente replica o passado e procura reproduzir as condições sob as quais a atividade histórica que estudamos poderia ter acontecido.
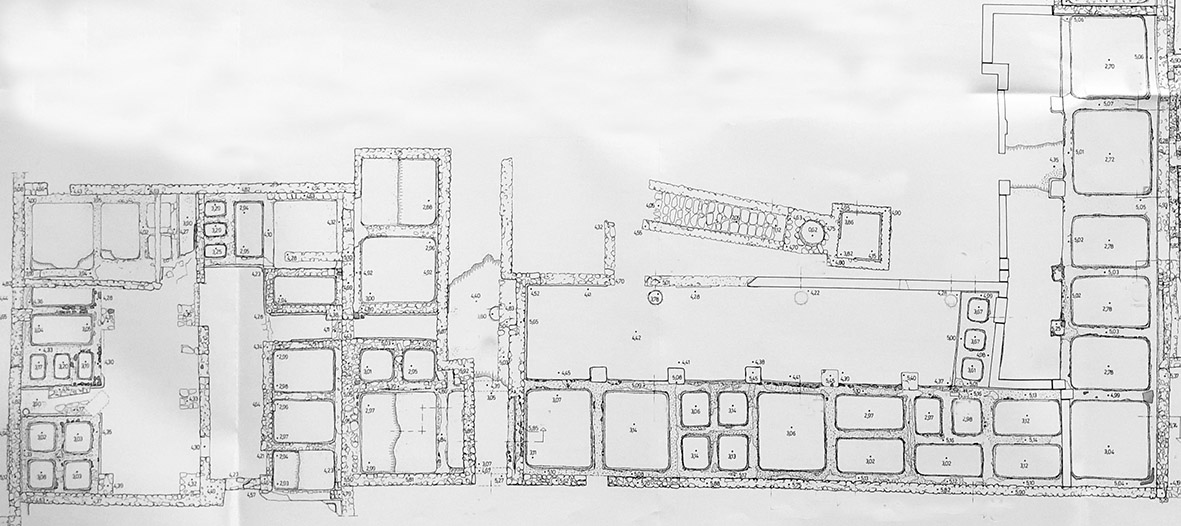

Imagens em: Un grand complexe industriel a Tróia (Portugal) de Robert ETIENNE, Yasmine MAKAROUN, Françoise MAYET 1994
Já realizámos diversas experiencias em condições controladas, mas neste caso a nossa escolha foi replicar as condições possíveis, e não replicar uma receita da antiguidade diretamente num tanque aberto ao calor do sol.
Assim foi utilizada sardinha (Sardine pilchardus) pescada na águas de Setúbal no dia anterior à preparação do Garum, e sal produzido no estuário do Sado, dois ingredientes que são determinantes para o produto final, procurando replicar as condições da época antiga quanto à matéria prima utilizada na época.
Outros fatores que influenciam de forma determinante a qualidade do Garum são a localização geográfica onde o mesmo é produzido, que neste caso é rigorosamente a mesma. Também a época em que o Garum era produzido, sendo mantido assim o mesmo período do ano, de forma a procurar ter condições atmosféricas semelhantes, como exposição solar, temperatura e humidade do ar.

Dado que os tanques originais têm as paredes gastas, com fraturas e musgo ou líquenes, não era recomendável o contacto directo com as paredes. Optámos assim por utilizar um saco de polipropileno de 90 mícrones, de 1000 litros de capacidade, (Flexitank Embatank),com certificação de qualidade alimentar, que ficou em contacto com as paredes da cetária, absorvendo desta forma o calor das paredes de pedra e reproduzindo assim a temperatura diurna e noturna da época do ano em que o Garum era produzido.
FLEXITANK EMBATANK 1000LT.
IBC flexible designed to transport liquids on liners
Volume: 1,000 L
Top Filling
Dimensions: 1050 x 1050 x 970

Outro dos fatores que influencia a produção de Garum é o contato ou não com o ar. Supõe-se que os tanques fossem tapados com esteiras pelos Romanos, existindo dessa forma um contato total com o ar, embora o Garum possa ser também produzido de forma hermética. No entanto é de prever a libertação de gases e, de forma a reproduzir aproximadamente o modo de produção em Tróia, a nossa opção neste caso foi de deixar o saco parcialmente aberto para permitir trocas gasosas, mas ao mesmo tempo evitar a possibilidade de exagerada evaporação, que pudesse secar o Garum.
Quando o Garum era produzido em tanques abertos existem evidencias de que a perda de líquido era compensada com a reposição de água, fator que pretendemos evitar, até porque numa oficina de produção romana a atividade e controle eram permanentes, não sendo viável presentemente verificar diariamente a consistência do preparado.
Por cima foi colocada uma esteira de vime de forma a evitar a exposição solar desprotegida.



Para além da colaboração do departamento de arqueologia das ruínas de Tróia, sem o qual não teria sido possível esta experiência, o projecto conta ainda com a participação das investigadoras na área alimentar Marisa Santos, Catarina Prista e Anabela Raymundo do Centro de Investigação em Agronomia, Alimentos, Ambiente e Paisagem do Instituto Superior de Agronomia, e da zooarqueóloga Sónia Gabriel e da palinóloga Patrícia Mendes, ambas do Laboratório de Arqueociências da Direcção Geral do Património Cultural.
A evolução do Garum será acompanhada de análises regulares, que nos permitirão compreender melhor este processo e registrar a evolução deste precioso molho.
Supervisão técnica do texto: Arqueóloga Inês Vaz Pinto – TROIA RESORT – Ruínas Romanas de Tróia































CAN THE CAN
Manager, Elsa Henriques
Chef Pedro Almeida
Sous chef Ruben Oliveira
Produção, Marlene Amaro
Investigação e projecto, Victor Moura Vicente
Ruínas Romanas de Tróia
Arqueólogas Inês Vaz Pinto e Patrícia Brum
ANICP, Associação Nacional dos Industriais de Conservas de Peixe
Marta Azevedo
Fotografia
Mariana Motta Veiga
Centro de Investigação em Agronomia, Alimentos, Ambiente e Paisagem do Instituto Superior de Agronomia
Marisa Santos, Catarina Prista e Anabela Raymundo
Laboratório de Arqueociências da Direcção Geral do Património Cultural
Zooarqueóloga Sónia Gabriel e da palinóloga Patrícia Mendes
Fornecimento de sardinha
Sesibal – Cooperativa de Pescas de Setubal, Sesimbra e Sines, Ricardo Santos
Fornecimento de sal do Vale do Sado
Carlos Bicha & Filhos, Lda, Alcácer do Sal
Colaboração especial
Prata de Mel, João Pratas e Ana Cavaca

Customer Care
O CAN THE CAN utiliza cookies para lhe proporcionar uma melhor experiência online. Ao continuar a sua visita ao nosso site, concorda com a utilização de cookies.
Contact
reservations@canthecan.net
info@canthecan.net
T. +351 914 007 100
T. +351 218 851 392
Terreiro do Paço 82/83
1100-148 Lisboa – Portugal
Open everyday from 9:00 AM to 1:00 AM